Ácidos Policarboxílicos
Ácidos Policarboxílicos. Los carboxílicos tienen como fórmula general R-COOH. … Generalmente los carboxílicos son ácidos débiles, con sólo un 1 % de sus moléculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolución acuosa. Un Ácido Policarboxílico es un compuesto orgánico perteneciente al grupo de los ácidos orgánicos. El Ácido Policarboxílico se caracteriza por tener tres o más grupos carboxílico (-COOH).
Un ejemplo de Ácido Policarboxílico es el ácido cítrico:
COOH-CH2-COH(COOH)-CH2-COOH
Clasificación General de los Ácidos:
Los ácidos se pueden clasificar según diferentes criterios expuestos a continuación.
-
ÁCIDOS INORGÁNICOS O MINERALES:
Hidrácidos: compuestos binarios con fórmula HX, donde X es un no-metal (halógeno o anfígeno): HF ác. fluorhídrico HBr ác. bromhídrico, HCl ác. clorhídrico…
-
- Oxácidos u Oxoácidos: compuestos ternarios con fórmula HaXbOc, donde X es un no-metal o metal de transición: H2SO4 ác. sulfúrico H2SO3 ác. sulfuroso H2CO3 ác. carbónico…
-
ÁCIDOS ORGÁNICOS:
- Monocarboxílicos: compuesto orgánico con 1 grupo carboxilo (-COOH). CH3CH2CH2COOH…
- Dicarboxílicos: compuesto orgánico con 2 grupos carboxilo (-COOH). HOOC-(CH2)-COOH…
- Policarboxílicos: compuesto orgánico con más de 2 grupos carboxilo (-COOH). Ej: ácido cítrico
- Sulfónicos: compuesto con fórmula R–S(=O)2–OH donde R es una cadena carbonada. Ej: CH3SO2OH
-
SEGÚN LA FUERZA DEL ÁCIDO:
Ácidos Fuertes: en disolución acuosa se disocia completamente (HA → H+ + A–). HCl, H2SO4 …
Ácidos Débiles: en disolución acuosa se disocia parcialmente (HA ↔ H+ + A–). CH3COOH, HCN …
-
SEGÚN ÁTOMOS DE H QUE DONAN:
Ácidos Monopróticos: capaces de donar 1 protón por molécula en la disociación. HCOOH, C6H5COOH
Ácidos Dipróticos: capaces de donar 2 protones por molécula en la disociación. H2SO4 …
Ácidos Polipróticos: capaces de donar más de 2 protones por molécula. H3PO4 …
Características y propiedades
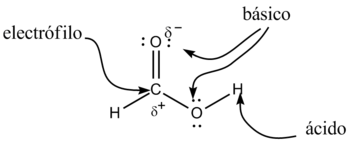
Los ácidos carboxílicos tienen como fórmula general R-COOH. Tienen propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones una ruptura heterolítica, cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO–.
Estos no solo son importantes y esenciales por su propia naturaleza, sino que además son la materia primas al momento de preparar los derivados de acilo, tales como : los cloruros de ácido, los ésteres,las amidas, y los tioésteres. Sin contar que en la mayoría de las rutas biológicas están presentes.
Generalmente los ácidos carboxílicos son ácidos débiles, con sólo un 1 % de sus moléculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolución acuosa.
Pero sí son más ácidos que otros, en los que no se produce esa deslocalización electrónica, como por ejemplo los alcoholes. Esto se debe a que la estabilización por resonancia o deslocalización electrónica, provoca que la base conjugada del ácido sea más estable que la base conjugada del alcohol y por lo tanto, la concentración de protones provenientes de la disociación del ácido carboxílico sea mayor a la concentración de aquellos protones provenientes del alcohol; hecho que se verifica experimentalmente por sus valores relativos menores de pKa. El ion resultante, R-COO–, se nombra con el sufijo «-ato».