El equilibrio químico es un estado de un sistema reaccionante en el que no se observan cambios a medida que transcurre el tiempo, a pesar de que sigue reaccionando entre sí las sustancias presentes.
En la mayoría de las reacciones químicas, los reactivos no se consumen totalmente para obtener los productos deseados, sino que, por el contrario, llega un momento en el que parece que la reacción ha concluido. Podemos comprobar, analizando los productos formados y los reactivo consumidos, que la concentración de todos permanece constante.
¿Significa esto que realmente la reacción se ha parado? Evidentemente no; una reacción en equilibrio es un proceso dinámico en el que continuamente los reactivos se están convirtiendo en productos y los productos en reactivos; cuando lo hacen a la misma velocidad nos da la sensación de que la reacción se ha paralizado.

Para que un sistema alcance el equilibrio termodinámico, debe lograr un estado de equilibrio térmico, mecánico y material.
El equilibrio térmico se genera cuando el sistema está a la misma temperatura con otro o con los alrededores.
El equilibrio mecánico se produce cuando las fuerzas que actúan sobre el sistema y las existentes en su interior se equilibran. Lo anterior, se relaciona con la presión.
En el equilibrio material no se observa ningún cambio neto de las propiedades macroscópicas del sistema; sin embargo, a nivel molecular continúa el movimiento, es decir, el equilibrio químico es dinámico.
Se asume generalmente que las reacciones químicas evolucionan en un solo sentido o dirección, desde los reactivos hacia los productos, pero no siempre es así.

Una reacción irreversible ocurre en forma espontánea hacia los productos, teniendo un sentido preferente de reacción, mientras que una reacción reversible puede ocurrir en ambos sentidos: una reacción directa y reacción inversa:

Se tiene la idea de que todas las reacciones químicas que se producen de forma espontánea alcanzan un 100% de avance, lo que puede suceder si alguno de los productos es gaseoso y se escapa del sistema de reacción; sin embargo, si la reacción se realiza en un sistema cerrado y es reversible, no se consigue la transformación total de los reactivos en productos, por lo tanto, una fracción de reactivos reaccionará y tanto reactivos como productos tenderán a alcanzar una concentración constante en el equilibrio químico.
Todo sistema fuera del equilibrio tiende a alcanzar una energía libre de Gibbs mínima.
El equilibrio químico es molecularmente un equilibrio dinámico. Esto significa que, desde el punto de vista cinético, la velocidad de la reacción directa es igual a la velocidad de la reacción inversa, y desde un punto de vista termodinámico, no se observa cambio macroscópico neto, aunque a nivel microscópico continúa la acción.
El equilibrio es independiente de la dirección desde la cual se alcanza. Una vez que se consigue, las concentraciones de reactivos y productos permanecen constantes, siempre que la temperatura se mantenga constante.
LEY DE ACCIÓN DE MASAS. CONSTANTE DE EQUILIBRIO (KC)
Para una reacción cualquiera (a A + b B + …. Á c C + d D + …) se define la constante de equilibrio (KC) de la siguiente manera:

siendo las concentraciones medidas en el equilibrio (no confundir con las concentraciones iniciales de reactivos y productos).
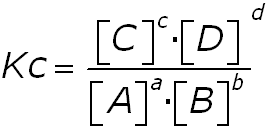
Se denomina constante de equilibrio, porque se observa que dicho valor es constante (dentro un mismo equilibrio) si se parte de cualquier concentración inicial de reactivo o producto.
En la reacción anterior: H2(g)+ I2(g) Á 2 HI (g)

El valor de KC, dada su expresión, depende de cómo se ajuste la reacción. Es decir, si la reacción anterior la hubiéramos ajustado como: ½ H2(g) + ½ I2(g) Á HI (g), la constante valdría la raíz cuadrada de la anterior.
La constante KC cambia con la temperatura.
¡ATENCIÓN!: Sólo se incluyen las especies gaseosas y/o en disolución. Las especies en estado sólido o líquido tienen concentración constante, y por tanto, se integran en la constante de equilibrio.
Ejemplo:
Tengamos el equilibrio: 2 SO2(g) + O2(g) Á 2 SO3(g). Se hacen cinco experimentos en los que se introducen diferentes concentraciones iniciales de ambos reactivos (SO2 y O2). Se produce la reacción y una vez alcanzado el equilibrio se miden las concentraciones tanto de reactivos como de productos observándose los siguientes datos:
| Concentr. iniciales (mol/l) | Concentr. equilibrio (mol/l) | ||||||
| [SO2] | [O2] | [SO3] | [SO2] | [O2] | [SO3] | Kc | |
| Exp 1 | 0,200 | 0,200 | — | 0,030 | 0,115 | 0,170 | 279,2 |
| Exp 2 | 0,150 | 0,400 | — | 0,014 | 0,332 | 0,135 | 280,1 |
| Exp 3 | — | — | 0,200 | 0,053 | 0,026 | 0,143 | 280,0 |
| Exp 4 | — | — | 0,700 | 0,132 | 0,066 | 0,568 | 280,5 |
| Exp 5 | 0,150 | 0,400 | 0,250 | 0,037 | 0,343 | 0,363 | 280,6 |
Kc se obtiene aplicando la expresión:

y como se ve es prácticamente constante.
Escribir las expresiones de KC para los siguientes equilibrios químicos: a) N2O4(g) Á 2 NO2(g); b) 2 NO(g) + Cl2(g) Á 2 NOCl(g); c) CaCO3(s) Á CaO(s) + CO2(g); d) 2 NaHCO3(s) Á Na2CO3(s) + H2O(g) + CO2(g). Ö
Significado del valor de Kc
Ejemplo:
En un recipiente de 10 litros se introduce una mezcla de 4 moles de N2(g) y 12 moles de H2(g); a) escribir la reacción de equilibrio; b) si establecido éste se observa que hay 0,92 moles de NH3(g), determinar las concentraciones de N2 e H2 en el equilibrio y la constante Kc.
a) Equilibrio: N2(g) + 3 H2(g) Á 2 NH3(g)
b) Moles inic.: 4 12 0
Moles equil. 4 – 0,46 = 3,54 12 – 1,38 = 10,62 0,92
conc. eq(mol/l) 0,354 1,062 0,092

En un recipiente de 250 ml se introducen 3 g de PCl5, estableciéndose el equilibrio: PCl5(g) Á PCl3 (g) + Cl2(g). Sabiendo que la KC a la temperatura del experimento es 0,48, determinar la composición molar del equilibrio. Ö
CONSTANTE DE EQUILIBRIO (KP). RELACIÓN CON KC.
En las reacciones en que intervengan gases es más sencillo medir presiones parciales que concentraciones. Así en una reacción tipo: a A + b B Á c C + d D, se observa la constancia de Kp viene definida por:
En la reacción: 2 SO2(g) + O2(g) Á 2 SO3(g)
De la ecuación general de los gases: se obtiene: p x V = n x R x T
n
p = —- x R x T = Molaridad x R x T
V
[SO3 ]2 x (RT)-1
Kp = —————————- = Kc x (RT)-1
[SO2 ]2 x (RT)2 x [O2 ] x (RT)
Vemos, pues, que KP puede depender de la temperatura siempre que haya un cambio en el nº de moles de gases

donde Dn = incremento en nº de moles de gases (nproductos– nreactivos)
Ejemplo:
Calcular la constante Kp a 1000 K en la reacción de formación del amoniaco vista anteriormente. (KC = 1,996 ·10–2 M–2)
N2(g) + 3 H2(g) Á 2 NH3(g)
Dn = nproductos – nreactivos = 2 – (1 + 3) = –2
KP = Kc x (RT)Dn =1,996 x 10‑2 mol‑2·l2 (0,082 atmxl x·mol‑1xK‑1 x1000 K) ‑2
Kp = 2,87 x 10-6 atm-2
La constante de equilibrio de la reacción: N2O4 Á 2 NO2 vale 0,671 a 45ºC. Calcule la presión total en el equilibrio en un recipiente que se ha llenado con N2O4 a 10 atmósferas y a dicha temperatura. Datos: R = 0,082 atm·l·mol-1·K-1. Ö
El valor de ambas constantes puede variar entre límites bastante grandes:
Ejemplos:
· H2(g) + Cl2(g) Á 2 HCl(g); Kc (298 K) = 2,5 x 1033
La reacción está muy desplazada a la derecha (en realidad se puede sustituir el símbolo Á por ®).
· H2(g) + I2(g) Á 2 HI(g); Kc (698 K) = 55,0
Se trata de un verdadero equilibrio (hay concentraciones apreciables de reactivos y productos).
· N2(g) + O2(g) Á 2 NO(g); Kc (298 K) = 5,3 x 10–31
La reacción está muy desplazada a la izquierda, es decir, apenas se forman productos.
Se utiliza en aquellas reacciones en las que existe un único reactivo que se disocia en dos o más moléculas más pequeñas.
Es la fracción de una mol que se disocia (tanto por 1). En consecuencia, el % de sustancia disociada es igual a 100·a.
Ejemplo:
En un matraz de 5 litros se introducen 2 moles de PCl5(g) y 1 mol de PCl3(g) y se establece el siguiente equilibrio: PCl5(g) Á PCl3(g) + Cl2(g). Sabiendo que Kc (250 ºC) = 0,042;
a) ¿cuáles son las concentraciones de cada sustancia en el equilibrio?;
b) ¿cuál es el grado de disociación?
a) Equilibrio: PCl5(g) Á PCl3(g) + Cl2(g)
Moles inic.: 2 1 0
Moles equil. 2– x 1 + x x
conc. eq(mol/l) (2– x) /5 (1 + x) /5 x/5
Resolviendo la ecuación de segundo grado, se deduce que x = 0,28 moles


; ;
b) Si de 2 moles de PCl5 se disocian 0,28 moles en PCl3 y Cl2, de cada mol de PCl5 se disociarán 0,14. Por tanto, a = 0,14, lo que viene a decir que el PCl5 se ha disociado en un 14 %.
Sea una reacción A Á B + C.
Si llamamos “c” = [A]inicial y suponemos que en principio sólo existe sustancia “A”, tendremos que:
Equilibrio: A Á B + C
Conc. Inic. (mol/l): c 0 0
conc. eq(mol/l) c (1– a) ca c· a
[PCI 3 ] . [CI2 ] c a x ca c a2
Kc = ———————- = ————– = ———-
[PCI5 ] c (1 – a) 1 – a
En el caso de que la sustancia esté poco disociada (KC muy pequeña): a << 1 y KC = c a2, con lo que se tiene a de manera inmediata. En caso de duda, puedes despreciar, y si ves que a< 0,02, puedes dejar el resultado, mientras que si a > 0,02 conviene que no desprecies y resuelvas la ecuación de segundo grado.
Ejemplo:
Utilizar la expresión de la constante en función de “a” en el ejemplo anterior: “En un matraz de 5 litros se introducen 2 moles de PCl5(g) y 1 mol de PCl3(g) y se establece el siguiente equilibrio: PCl5(g) Á PCl3(g) + Cl2(g). Sabiendo que Kc (250 ºC) = 0,042, ¿cuál es el grado de disociación?”.
Equilibrio: PCl5(g) Á PCl3(g) + Cl2(g)
Conc. inic.: 2/5 1/5 0
conc. eq(mol/l) 0,4(1–a) 0,2+0,4·a 0,4·a
[PCL3 ] . [CI2 ] (0,2 + 0,4 a ) x 0,4 a
Kc = —————— = ———————— = 0,042
[PCI5 ] 0,4 (1 – a )
En este caso y dado el valor de la constante no debe despreciarse a frente a 1, por lo que deberíamos resolver la ecuación de segundo grado: a = 0,14
En el equilibrio anterior (Kc = 0,042): PCl5(g) Á PCl3(g) + Cl2(g) ¿cuál sería el grado de disociación y el número de moles en el equilibrio de las tres sustancias si pusiéramos únicamente 2 moles de PCl5(g) en los 5 litros del matraz? Ö
A 450 ºC y 10 atm de presión el NH3 (g) está disociado en un 95,7 % según la reacción: 2 NH3 (g) Á N2 (g) + 3 H2 (g). Calcular KC y KP a dicha temperatura. Ö
En una reacción cualquiera: a A + b B Á c C + d D se llama cociente de reacción a:

Tiene la misma fórmula que la KC pero a diferencia de ésta, las concentraciones no tienen por qué ser las del equilibrio.
· Si Q = Kc entonces el sistema está en equilibrio.
· Si Q < Kcel sistema evolucionará hacia la derecha, es decir, aumentarán las concentraciones de los productos y disminuirán las de los reactivos hasta que Q se iguale con KC.
· Si Q > Kcel sistema evolucionará hacia la izquierda, es decir, aumentarán las concentraciones de los reactivos y disminuirán las de los productos hasta que Q se iguale con KC.
Una simulación de cómo varían las concentraciones de las diferentes sustancias a lo largo de un equilibrio químico y como Q tiende a KC
Ejemplo:
En un recipiente de 3 litros se introducen 0,6 moles de HI, 0,3 moles de H2 y 0,3 moles de I2 a 490ºC. Si Kc = 0,022 a 490ºC para 2 HI(g) Á H2(g) + I2(g) a) ¿se encuentra en equilibrio?; b) Caso de no encontrarse, ¿cuantos moles de HI, H2 e I2 habrá en el equilibrio?
a)
Como Q > Kc el sistemano se encuentraen equilibrio y la reacción se desplazará hacia la izquierda.
b)
Equilibrio: 2 HI(g) Á I2(g) + H2(g)
Moles inic.: 0,6 0,3 0,3
Moles equil. 0,6 + 2x 0,3 – x 0,3 – x
Resolviendo la ecuación se obtiene que: x = 0,163 moles
Equil: 2 HI(g) Á I2(g) + H2(g)
Mol eq: 0,6+2×0,163 0,3–0,163 0,3–0,163
n(HI) = 0,93 mol; n(I2) = 0,14 mol; n(H2) = 0,14 mol
MODIFICACIONES DEL EQUILIBRIO.
Si un sistema se encuentra en equilibrio (Q = Kc) y se produce una perturbación:
· Cambio en la concentración de alguno de los reactivos o productos.
· Cambio en la presión (o volumen).
· Cambio en la temperatura.
el sistema deja de estar en equilibrio y trata de volver a él.
Cambio en la concentración de alguno de los reactivos o productos.
Si una vez establecido un equilibrio se varía la concentración algún reactivo o producto el equilibrio desaparece y se tiende hacia un nuevo equilibrio.
Las concentraciones iniciales de este nuevo equilibrio son las del equilibrio anterior con las variaciones que se hayan introducido.
Lógicamente la constante del nuevo equilibrio es la misma, por lo que, si aumenta la concentración de algún reactivo, crecería el denominador en Q, y la manera de volver a igualarse a KC sería que disminuyera la concentración de reactivos (en cantidades estequiométricas) y, en consecuencia, que aumentasen las concentraciones de productos, con lo que el equilibrio se desplazaría hacia la derecha, es decir, se obtiene más producto que en condiciones iniciales.
De la manera, en caso de que disminuyera la concentración de algún reactivo: disminuiría el denominador en Q, y la manera de volver a igualarse a KC sería que aumentase la concentración de reactivos (en cantidades estequiométricas) y, en consecuencia, que disminuyesen las concentraciones de productos, con lo que el equilibrio se desplazaría hacia la izquierda, es decir, se obtiene menos producto que en condiciones iniciales.
Análogamente, podría argumentarse que, si aumentase la concentración de algún producto, el equilibrio se desplazaría a la izquierda, mientras que, si disminuyese, se desplazaría hacia la derecha.
Ejemplo:
En el equilibrio anterior: PCl5(g) Á PCl3(g) + Cl2(g) ya sabemos que, partiendo de 2 moles de PCl5(g) en un volumen de 5 litros, el equilibrio se conseguía con 1,45 moles de PCl5, 0,55 moles de PCl3 y 0,55 moles de Cl2 ¿cuántos moles habrá en el nuevo equilibrio si una vez alcanzado el primero añadimos 1 mol de Cl2 al matraz? (Kc = 0,042)
Equilibrio: PCl5(g) Á PCl3(g) + Cl2(g)
Moles inic.: 1,45 0,55 0,55 + 1
Moles equil. 1,45 + x 0,55 – x 1,55 – x
Resolviendo la ecuación se obtiene que: x = 0,268
Equilibrio: PCl5(g) Á PCl3(g) + Cl2(g)
neq (mol) 1,45+0,268 0,55–0,268 1,55–0,268
1,718 0,282 1,282
conc (mol/l) 0,3436 0,0564 0,2564
El equilibrio se ha desplazado a la izquierda. Se puede comprobar como:
Cambio en la presión (o volumen)
En cualquier equilibrio en el que haya un cambio en el número de moles en sustancias gaseosas entre reactivos y productos, como por ejemplo en reacciones de disociación del tipo: A Á B + C, ya se vio que KC@ c x a2
Al aumentar “p” (o disminuir el volumen) aumenta la concentración y eso lleva consigo una menor “a”, es decir, el equilibrio se desplaza hacia la izquierda que es donde menos moles hay.
Este desplazamiento del equilibrio al aumentar la presión, hacia donde menos moles de sustancias gaseosas, es válido y generalizable para cualquier equilibrio en el que intervengan gases. Lógicamente, si la presión disminuye, el efecto es el contrario.
Si el número de moles gaseosos total de reactivos es igual al de productos se pueden eliminar todos los volúmenes en la expresión de KC,con lo que éste no afecta al equilibrio (y por tanto, tampoco la presión).
¡CUIDADO!: El cambio de presión apenas afecta a sustancias líquidas (incluyendo disoluciones) o sólidas, por lo que, si en una reacción no interviene ningún gas, estos cambios no afectarán al equilibrio.
Ejemplo:
Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 de yodo, se calienta a 400ºC con lo que al alcanzar el equilibrio se obtienen 4.5 moles de HI, siendo el volumen del recipiente de reacción de 10 litros. Calcule: a) El valor de las constantes de equilibrio Kc y Kp;b) La concentración de los compuestos si el volumen se reduce a la mitad manteniendo constante la temperatura a 400ºC.
a) Equilibrio: H2 (g) + I2 (g) Á 2 HI (g)
Moles inic.: 3,5 2,5 0
Moles equil: 1,25 0,25 4,5
conc. eq(mol/l) 0,125 0,025 0,45
b) En este caso, el volumen no influye en el equilibrio, pues al haber el mismo nº de moles de reactivos y productos, se eliminan todas las “V” en la expresión de KC.
Por tanto, las concentraciones de reactivos y productos, simplemente se duplican:
Se puede comprobar como:
Cambio en la temperatura.
Se observa que, al aumentar T, el sistema se desplaza hacia donde se consuma calor, es decir, hacia la izquierda en las reacciones exotérmicas y hacia la derecha en las endotérmicas.
Si disminuye T el sistema se desplaza hacia donde se desprenda calor (derecha en las exotérmicas e izquierda en las endotérmicas).
Ejemplo:
¿Hacia dónde se desplazará el equilibrio al: a) disminuir la presión? b) aumentar la temperatura? H2O(g) + C(s) Á CO(g) + H2(g) (DH > 0)
Hay que tener en cuenta que las concentraciones de los sólidos ya están incluidas en la KC por ser constantes.
a) Al bajar «p» el equilibrio se desplaza hacia la derecha (donde más moles de gases hay: 1 de CO + 1 de H2 frente a 1 sólo de H2O)
b) Al subir «T» el equilibrio también se desplaza hacia la derecha (donde se consume calor por ser la reacción endotérmica).
Equilibrio químico
Principio de Le Chatelier. Variaciones en el equilibrio.
“Un cambio o perturbación en cualquiera de las variables que determinan el estado de equilibrio químico produce un desplazamiento del equilibrio en el sentido de contrarrestar o minimizar el efecto causado por la perturbación”.
· D[reactivos] > 0 ¾¾®
· D[reactivos] < 0 ¬¾¾
· D[productos] > 0 ¬¾¾
· D[productos] < 0 ¾¾®
· DT > 0 (exotérmicas) ¬¾¾
· DT > 0 (endotérmicas) ¾¾®
· DT < 0 (exotérmicas) ¾¾®
· DT < 0 (endotérmicas) ¬¾¾
· Dp > 0 Hacia donde menos nº moles de gases
· Dp < 0 Hacia donde más nº moles de gases.
Una visualización de cómo varían las cantidades en el equilibrio al variar las condiciones
Importancia en procesos industriales.
El saber qué condiciones favorecen el desplazamiento de un equilibrio hacia la formación de un producto es de suma importancia en la industria, pues se conseguirá un mayor rendimiento, en dicho proceso.
Un ejemplo típico es la síntesis de Haber en la formación de amoniaco a partir de la reacción N2(g) + 3 H2(g) Á 2 NH3(g), exotérmica. La formación de amoniaco está favorecida por altas presiones (menos moles gaseosas de productos que de reactivos) y por una baja temperatura. Por ello esta reacción se lleva a cabo a altísima presión y a una temperatura relativamente baja, aunque no puede ser muy baja para que la reacción no sea muy lenta. Hay que mantener un equilibrio entre rendimiento y tiempo de reacción.
Equilibrio químico
Se habla de reacción homogénea cuando tanto reactivos como productos se encuentran en el mismo estado físico. En cambio, si entre las sustancias que intervienen en la reacción se distinguen varias fases o estados físicos, hablaremos de reacciones heterogéneas.
Por ejemplo, la reacción: CaCO3(s) Á CaO(s) + CO2(g) se trata de un equilibrio heterogéneo.
Aplicando la ley de acción de masas se cumplirá que:
Sin embargo, las concentraciones (n/V) de ambas sustancias sólidas (CaCO3 y CaO) son constantes, al igual que las densidades de sustancias puras (m/V) son también constantes.
Por ello, agrupando las constantes en una sola a la que llamaremos KC se tiene:
Análogamente: KP = p (CO2)
¡ATENCIÓN!: En la expresión de KC de la ley de acción de masas sólo aparecen las concentraciones de gases y sustancias en disolución, mientras que en la expresión de KP únicamente aparecen las presiones parciales de las sustancias gaseosas.
Ejemplo:
En un recipiente se introduce cierta cantidad de carbonato amónico, NH4CO2NH2 sólido que se disocia en amoniaco y dióxido de carbono cuando se evapora a 25ºC. Sabiendo que la constante KP para el equilibrio NH4CO2NH2(s) Á 2 NH3(g) + CO2(g) y a esa temperatura vale 2,3·10-4. Calcular KC y las presiones parciales en el equilibrio.
Equilibrio: NH4CO2NH2(s) Á2 NH3(g) + CO2(g)
n(mol) equil. n – x 2x x
Luego p(NH3) = 2 p (CO2) ya que la presión parcial es directamente proporcional al nº de moles.
Kp = 2,3×10-4 = p(NH3)2 x p (CO2) = 4p (CO2)3
Despejando se obtiene que: p (CO2) = 0,039 atm con lo que: p(NH3) = 0,078 atm.
REACCIONES DE PRECIPITACIÓN. ·
Son reacciones de equilibrio heterogéneo sólido-líquido.
La fase sólida contiene una sustancia poco soluble (normalmente una sal). La fase líquida contiene los iones producidos en la disociación de la sustancia sólida.
Normalmente el disolvente suele tratarse de agua.
Solubilidad (s).
Es la máxima concentración molar de soluto en un determinado disolvente, es decir, la molaridad de la disolución saturada de dicho soluto.
Depende de:
· La temperatura. Normalmente es mayor a mayor temperatura debido a la mayor energía del cristal para romper uniones entre iones.
· Energía reticular. Si la energía de solvatación es mayor que la reticular U se favorece la disolución. A mayor carácter covalente mayor U y por tanto menor solubilidad.
· La entropía. Al diluirse una sal se produce un sistema más desordenado por lo que, aunque energéticamente no esté favorecida la disolución ésta puede llegar a producirse.
Equilibrio químico
Producto de solubilidad (KS o PS) en electrolitos de tipo AB.
En un electrolito de tipo AB el equilibrio de solubilidad viene determinado por:
AB(s) Á A+(ac) + B–(ac)
Conc. inic. (mol/l): c 0 0
Conc. eq. (mol/l): c s s
La concentración del sólido permanece constante.
Y la constante de equilibrio tiene la expresión:
Þ
Ejemplo: AgCl(s) Á Ag+(ac) + Cl –(ac)
KS = [Ag+] x [Cl–] = s2
“s” es la solubilidad de la sal.
Ejemplo:
Deduce si se formará precipitado de cloruro de plata cuyo KS = 1,7 x 10-10 a 25ºC al añadir a 250 cm3 de cloruro de sodio 0,02 M 50 cm3 de nitrato de plata 0,5 M.
AgCl(s) Á Ag+(ac) + Cl–(ac)
KS = [Ag+] x [Cl–] = s2
n (Cl–) = 0,25 L x 0,02 mol/L = 0,005 mol Þ
Igualmente:
n(Ag+) = 0,05 L x 0,5 mol/L = 0,025 mol Þ
[Ag+] x [Cl–] = 0,0167 M x 0,0833 M =1,39 x 10-3 M2
Como [Ag+] x [Cl–] > KS entonces precipitará.
Producto de solubilidad en otro tipo de electrolito.
Tipo A2B: A2B (s) Á 2 A+(ac) + B2– (ac)
Conc. inic. (mol/l): c 0 0
Conc. eq. (mol/l): c 2s s
Y la constante de equilibrio tiene la expresión:
Las mismas expresiones será para electrolitos tipoAB2.
Tipo AaBb: AaBb (s) Á a Ab+(ac) + b Ba–(ac)
Conc. inic. (mol/l): c 0 0
Conc. eq. (mol/l): c as bs
Equilibrio químico
FACTORES QUE AFECTAN A LA SOLUBILIDAD. ·
Además de la temperatura, existen otros factores que influyen en la solubilidad por afectar a la concentración de uno de los iones de un electrolito poco soluble. Estos son:
· Efecto ion común.
– Formación de un ácido débil.
– Formación de una base débil.
· pH.
· Formación de complejos estables.
· Reacciones redox.
Efecto ion común.
Si a una disolución saturada de un electrolito poco soluble añadimos otra sustancia que aporta uno de los iones, la concentración de éste aumentará.
Lógicamente, la concentración del otro ion deberá disminuir para que el producto de las concentraciones de ambos permanezca constante.
Como el equilibrio se desplaza a la izquierda la solubilidad, que mide la máxima concentración de soluto disuelto, disminuirá en consecuencia.
Ejemplo:
¿Cuál será la solubilidad del cloruro de plata si añadimos nitrato de plata hasta una concentración final 0,002 M?
AgCl(s) Á Ag+(ac) + Cl –(ac)
KS = 1,7 x 10-10 = [Ag+] x [Cl–] = s2
Al añadir el AgNO3, la [Ag+] sube hasta 2 x10-3 M, pues se puede despreciar la concentración que había antes.
En consecuencia, el equilibrio se desplaza a la izquierda y la [Cl–], es decir, la nueva solubilidad, debe disminuir.
Ejercicio:
En equilibrio de disolución de bromuro de platacuya Ks=5,2 x 10-13 ¿cuál será la nueva solubilidad si a ½ litro de disolución saturada se AgBr se le añaden 0,2 ml de una disolución 0,001 M de bromuro de potasio?
Equilibrio: AgBr (s) Á Ag+ (ac) + Br–(ac)
Conc. eq. (mol/l): c s s
KS = 5,2 x 10–13 = [Ag+] x [Br–] = s2 Þ
n(Br–)0 = 0,5 L x 7,2×10–7 mol/L = 3,6×10–7 mol
n(Br–)añad = 0,0002 L x 0,001 mol/L = 2×10–7 mol
Conc. inic. (mol/l): c 7,2×10–7 1,12×10–6
Conc. eq. (mol/l): c 7,2×10–7 –x 1,12×10–6 –x
KS = 5,2 x 10-13 = (7,2×10-7 –x)·(1,12×10-6 –x) Þ x = 3,2 x 10-7
s’ = (7,2 x 10–7 -3,2 x 10–7)M = 4,0 x10–7 M
Influencia del pH por formación de un ácido débil.
Equilibrio solubil: AB(s) Á A– (ac) + B+ (ac)
Equilibrio acidez: HA(ac) Á A– (ac) + H+ (ac)
Si el anión A– en que se disocia un electrolito poco soluble forma un ácido débil HA, al aumentar la acidez o [H+]el equilibrio de disociación del ácido se desplazará hacia la izquierda.
En consecuencia, disminuirá [A–], con lo que se solubilizará más electrolito AB.
Ejemplo: al añadir un ácido fuerte sobre el ZnCO3, se formará H2CO3, ácido débil, y al disminuir [CO32-], se disolverá más ZnCO3, pudiéndose llegar a disolver por completo.
Equilibrio químico
Cambio en la solubilidad por formación de una base débil.
Suele producirse a partir de sales solubles que contienen el catión NH4+.
Ejemplo: NH4Cl(s) ± Cl– (ac) + NH4+ (ac)
Equil base: NH4OH (ac) Á NH4+ (ac) + OH– (ac)
Los NH4+ reaccionan con los OH– formándose NH4OH al desplazar el equilibrio de la base hacia la izquierda.
Es el método usual de disolver hidróxidos poco solubles tales como el Mg(OH)2.
Equil. Solub.: Á Mg2+(ac) + 2 OH–(ac).
En consecuencia, disminuirá [OH–], con lo que se solubilizará más Mg(OH)2.
Formación de un complejo estable.
Un ion complejo es un ion formado por más de un átomo o grupo de átomos.
Ejemplos: [Al(OH)4]–, [Zn(CN)4]2-, [AlF6]3- , [Ag(NH3)2]+.
De esta manera, se pueden disolver precipita-dos añadiendo, por ejemplo, cianuro de sodio a electrolitos insolubles de cinc como el Zn(OH)2, ya que al formarse el catión [Zn(CN)4]2 –, que es muy estable.
Así, disminuirá drásticamente la concentración de Zn2+, con lo que se disolverá más Zn(OH)2.
Igualmente, pueden disolverse precipitados de AgCl añadiendo amoniaco.
Equilibrio químico
Oxidación o reducción de iones.
Si alguno de los iones que intervienen en un equilibrio de solubilidad se oxida o se reduce como consecuencia de añadir un oxidante o reductor, la concentración de este ion disminuirá.
En consecuencia, el equilibrio del electrolito insoluble se desplazará hacia a la derecha, disolviéndose en mayor cantidad.
Ejemplo: El CuS se disuelve fácilmente en ácido nítrico, ya que éste es oxidante y oxida el S2- a S0.
3 CuS + 2 NO3– + 8 H+ Á 3 S0 + 3 Cu2+ + 2 NO + 4 H2O.
En realidad, el CuS se transforma en Cu(NO3)2 mucho más soluble, al desaparecer los iones S2– de la disolución.
Ejemplos:
Tenemos una mezcla de H2(g), O2(g) y H2O(g) a una determinada temperatura y con la siguiente información:
Mezcla de gases Masa (g) M (g/mol) ngas
H2(g) 0,8 2 0,4 mol
O2(g) 6,4 32 0,2 mol
H2O(g) 10,8 18 0,6 mol
Nmezcla= 1,2 mol
Equilibrio químico
- Fracción molar de un gas
Y =
Se concluye que
- Masa molar de una mezcla de gases
Se calcula en función de las fracciones y masa molares de los gases que constituyen la mezcla.
Para el ejemplo tenemos:
mezcla=(yx )H2 + (y x H2O
reemplazamos:
= (0,33 x 2) + (0,17 x 32) + (0,5 x 18) = 15,1 g/mol
- Ley de Dalton de las presiones parciales
La presión total de una mezcla de gases es igual a la suma de presiones parciales. La presión parcial de un gas (Pgas) es aquella que ejerce cuando presenta iguales condiciones de volumen y temperatura que la mezcla.
Ejemplo,
Consideremos que la presión de la mezcla de gases del ejemplo anterior es 16 atm, así tenemos:
Mezcla de gases y Pparcial
H2 0,33
O2 0,17
H2O 0,5
Pmezcla=16 atm
Equilibrio químico
Según Dalton
Pmezcla =
¿Cómo se halla la presión parcial?
Según la ley de Dalton se calcula así:
Pgas = Ygas = Pmezcla
Equilibrio químico
- Ley de Amagat de volúmenes parciales.
El volumen de una mezcla de gases es igual a la suma de volúmenes parciales. Un volumen parcial (Vgas) es aquel que un gas presenta cuando posee las mismas condiciones de presión y temperatura que la mezcla.
Ejemplo:
Consideremos que el volumen de la mezcla gaseosa del ejemplo es 20L, así tenemos:
Mezcla y Vparsial
H2 0,33
O2 0,17
H2O 0,5
Vmezcla= 20L
Según Amagat
Vmezcla = + +
¿Cómo hallar el volumen parcial?
Según esta ley se usa la expresión:
Vgas = Ygas ∙ Vmezcla
- Identidad de Avogadro
La siguiente conclusión, se usa en muchos problemas de equilibrio químico:
Despejando la fracción molar de un gas.
Ygas =
Dalton Amagat
Multiplicando por 100% a cada expresión:
100%ygas =
Se cumple en una mezcla de gases:
100%ygas = %ngas = %Pgas = %Vgas
composición composición composición
molar en presión volumétrica
de los ejemplos anteriores:
%
%
%
- Ley de velocidad de Guldberg y Waage.
La velocidad de una reacción química es directamente proporcional a la concentración molar de los reactantes.
Sea la reacción general elemental:
aA(g) + bB(g) (g) +dD(g)
a x b
Unidades:
Donde:
- []: concentración mol/L
- K: constante específica de velocidad
- a: orden de la reacción respecto aA
- b: orden de reacción respecto a B
- a + b: orden total de la reacción
directamente
K T
proporcional
Equilibrio químico
- T: temperatura de la reacción
Ejemplo:
Exprese la ley de velocidad de las siguientes reacciones elementales.
- N2(g) + 3H2(g) →2NH3(g)
Vg x N=K [N2][H2]3 orden de la reacción = 4
- 1S2(g) + 2º2(g) → 2SO2(g)
Vg x N= K[S2][O2]2 orden de reacción = 3
- Relación entre el número de moles (n), concentración ([ ]) y presión de un gas durante el desarrollo de una reacción química.
Las reacciones químicas en tema de equilibrio químico se desarrollarán en recipientes cerrados (volumen del sistema constante) y a una determinada temperatura, del cual podemos concluir las siguientes relaciones de cantidad.
Relación entre concentración y moles.
Como el Vrecipiente es constante se concluye
directamente
[gas] ngas
proporcional
relación entre presión parcial y moles
usamos la ecuación universal
Pgas x Vrecipiente =R x T x ngas
Por las condiciones del equilibrio tenemos
constante
concepto
se concluye que:
directamente
Pgas ngas
proporcional
finalizamos diciendo que para un gas que participa en una relación química que alcanza el equilibrio, se cumple que las cantidades consumidas o formadas de moles, presión y concentración molar son proporcionales entre sí.
Ejemplo:
En la síntesis de Haber Bosch
1N2(g) + 3H2(g)
| relación de moles relación de presión relación de [ ] |
| se consumen |
| 1 mol 3 mol → 2 mol |
| 4 mol 12 mol → 6 mol |
| 1 atm 3 atm → 2 atm |
| 4 atm 12 atm → 6 atm |
| 1 M 3 M → 2 M |
| 4 M 12 M → 6 M |
Equilibrio químico
Concepto.
Es aquel estado que alcanza una reacción química reversible a una determinada temperatura en el cual sus diversas propiedades como, presión, masa, concentración de sus sustancias, calor, densidad etc., se mantienen constantes con el paso del tiempo.
Ejemplo:
A eso °C introducimos en un recipiente 11 M de H2(g) y 10 M de 12(g)
Luego lo cerramos para que se alcance el estado de equilibrio. El sistema inicial es:
En el siguiente cuadro se indica como varían las concentraciones con el paso del tiempo.
H2(g) + I2(g) 2HI(g)
t = 0 11 M 10 M 0 M al inicio de la reacción (t = 0) solo hay
t = 5’ 7 M 6 M 8 M reactantes en el sistema. Conforme pasa el tiempo, la concentración
t = 15’ 4,5 M 3,5 M 13M de los reactantes disminuye y la de los productos aumenta.
t = 60’ 3 M 2 M 16 M a los 60 minutos la reacción alcanza el estado de equilibrio. luego conforme para
t = 120’ 3 M 2 M 16 M el tiempo, las concentraciones de las sustancias permanecen constantes.
t = 160’ 3 M 2 M 16 M
Observación:
- El tiempo que demora una reacción para alcanzar el equilibrio químico es variable, en nuestro ejemplo fue de 60 minutos.
- La reacción química alcanza el estado de equilibrio siempre y cuando la temperatura no varié durante el desarrollo de la reacción.
Equilibrio químico
Características
- A nivel macroscópico, el equilibrio se denomina estático ya que no se observan cambios en las propiedades del sistema.
- A nivel microscópico, la reacción directa e inversa se desarrolla a igual velocidad y el equilibrio se llama dinámico. Es decir que los reactivos se siguen consumiendo tomando productos y estos últimos también reaccionan generando a los reactantes.
Se cumple velocidad de la velocidad de la
reacción directa reacción inversa
=
- Para alcanzar el estado de equilibrio a partir de los restantes, estos se consumen de manera parcial y en el sistema final encontraremos una mezcla de todas las sustancias.
Del ejemplo inicial:
H H2(g) ← 11M H2(g) ← 3M
I2(g) ← 10M I2(g) ← 2M Se forma una mezcla de gases
HI(g) ← 16 M
- El equilibrio químico se alcanza de forma espontánea: es decir, no importando algunos factores extremos como la presión, el volumen del recipiente, la concentración inicial de las sustancias. Etc. Con el paso del tiempo, el sistema llegará al equilibrio.
Ejemplo:
Dos personas de lugares distintos una de Lima y la otra de Huancavelica, tienen diferente alimentación, soportan distintas presiones atmosféricas, etc.; sin embargo, ambas internamente han alcanzado un estado de equilibrio donde su temperatura corporal y pH sanguíneo son de forma aproximada 37°C y 7,4 respectivamente.
- Grafica concentración vs tiempo
Para el ejemplo inicial:
H2(g) + I2(g) 2HI(g)
[] mol/L
HI
16
Se observa que a partir de los 60 min las concentraciones permanecen
11 constantes, ya que se alcanzó el equilibrio químico.
10
3 H2
2 I2
0
60’ t(min)
Nota:
La concentración molar de las sustancias se simboliza con corchetes.










