Entropía
En termodinámica, la entropía (simbolizada como S) es una magnitud física que para un sistema termodinámico en equilibrio mide el número de microestados compatibles con el macroestado de equilibrio, también se puede decir que mide el grado de organización del sistema, o que es la razón de un incremento entre energía interna frente a un incremento de temperatura del sistema.
La entropía es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se da de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos. La palabra entropía procede del griego (ἐντροπία) y significa evolución o transformación. Fue Rudolf Clausius quien le dio nombre y la desarrolló durante la década de 1850; y Ludwig Boltzmann, quien encontró en 1877 la manera de expresar matemáticamente este concepto, desde el punto de vista de la probabilidad.
Cuando se plantea la pregunta: «¿Por qué ocurren los sucesos en la Naturaleza de una manera determinada y no de otra manera?», se busca una respuesta que indique cuál es el sentido de los sucesos. Por ejemplo, si se ponen en contacto dos trozos de metal con distinta temperatura, se anticipa que finalmente el trozo caliente se enfriará, y el trozo frío se calentará, finalizando en equilibrio térmico. El proceso inverso, el calentamiento del trozo caliente y el enfriamiento del trozo frío es muy improbable que se presente, a pesar de conservar la energía. El universo tiende a distribuir la energía uniformemente; es decir, a maximizar la entropía. Intuitivamente, la entropía es una magnitud física que, mediante cálculo, permite determinar la parte de la energía por unidad de temperatura que no puede utilizarse para producir trabajo.
La función termodinámica entropía es central para el segundo principio de la termodinámica. La entropía puede interpretarse como una medida de la distribución aleatoria de un sistema. Se dice que un sistema altamente distribuido al azar tiene alta entropía. Un sistema en una condición improbable tendrá una tendencia natural a reorganizarse a una condición más probable (similar a una distribución al azar), reorganización que dará como resultado un aumento de la entropía. La entropía alcanzará un máximo cuando el sistema se acerque al equilibrio, y entonces se alcanzará la configuración de mayor probabilidad.
Una magnitud es una función de estado si, y sólo si, su cambio de valor entre dos estados es independiente del proceso seguido para llegar de un estado a otro. Esa caracterización de función de estado es fundamental a la hora de definir la variación de entropía.
La variación de entropía nos muestra la variación del orden molecular ocurrido en una reacción química. Si el incremento de entropía es positivo, los productos presentan un mayor desorden molecular (mayor entropía) que los reactivos. En cambio, cuando el incremento es negativo, los productos son más ordenados. Hay una relación entre la entropía y la espontaneidad de una reacción química, que viene dada por la energía de Gibbs.
Entropía y termodinámica
Se entiende por entropía a un tipo de magnitud física que calcula aquella energía que existe en un determinado objeto o elemento pero que no es útil para realizar un trabajo o esfuerzo. La entropía es aquella energía que no es utilizable ante el advenimiento de un proceso termodinámico, por ejemplo, la puesta en circulación de una determinada cantidad de energía a partir de la reacción de uno o más elementos. Así, en términos más cercanos al léxico común, la entropía podría ser descripta como la energía que resulta desechable ante un proceso termodinámico, aquella energía que no es utilizada y que por tanto no es considerada útil para tal proceso.
Dentro de la termodinámica o rama de la física que estudia los procesos que surgen a partir del calentamiento de energías y de la puesta en movimiento de diferentes elementos naturales. La entropía figura dentro de esta rama de la física como una especie de desorden de todo aquello que es sistematizado, es decir, como la referencia o la demostración de que cuando algo no es controlado puede transformarse y desordenarse. La entropía, además, supone que de ese caos o desorden existente en un sistema surja una situación de equilibrio u homogeneidad que, a pesar de ser diferente a la condición inicial, suponga que las partes se hallan ahora igualadas o equilibradas.
Esta idea de desorden termodinámico fue plasmada mediante una función ideada por Rudolf Clausius a partir de un proceso cíclico reversible. En todo proceso reversible la integral curvilínea de
sólo depende de los estados inicial y final, con independencia del camino seguido (δQ es la cantidad de calor absorbida en el proceso en cuestión y T es la temperatura absoluta). Por tanto, ha de existir una función del estado del sistema, S=f(P,V,T), denominada entropía, cuya variación en un proceso reversible entre los estados 1 y 2 es:
-
.
Téngase en cuenta que, como el calor no es una función de estado, se usa δQ, en lugar de dQ. La entropía física, en su forma clásica, está definida por la ecuación siguiente:
o, más simplemente, cuando no se produce variación de temperatura (proceso isotérmico):
donde S es la entropía, Q 1 → 2 
Unidades: S=[cal/K]
Los números 1 y 2 se refieren a los estados iniciales y finales de un sistema termodinámico.
Significado
El significado de esta ecuación es el siguiente:
|
De acuerdo con la ecuación, si el calor se transfiere al sistema, también lo hará la entropía, en la misma dirección. Cuando la temperatura es más alta, el flujo de calor que entra produce un aumento de entropía menor. Y viceversa.
Las unidades de la entropía, en el Sistema Internacional, son el J/K (o Clausius), definido como la variación de entropía que experimenta un sistema cuando absorbe el calor de 1 julio a la temperatura de 1 Kelvin.
Cuando el sistema evoluciona irreversiblemente, la ecuación de Clausius se convierte en una inecuación:
Siendo el sumatorio de las i fuentes de calor de las que recibe o transfiere calor el sistema y la temperatura de las fuentes. No obstante, sumando un término positivo al segundo miembro, podemos transformar de nuevo la expresión en una ecuación:
Al término σ p {\displaystyle {\sigma }_{p}} 
Cero absoluto
Solo se pueden calcular variaciones de entropía. Para calcular la entropía de un sistema, es necesario fijar la entropía del mismo en un estado determinado. El tercer principio de la termodinámica fija un estado estándar: para sistemas químicamente puros, sin defectos estructurales en la red cristalina, de densidad finita, la entropía es nula en el cero absoluto (0 K) o (-273.16°C)
Esta magnitud permite definir el segundo principio de la termodinámica, de la cual se deduce que un proceso tiende a darse de forma espontánea en un cierto sentido solamente. Por ejemplo: un vaso de agua no empieza a hervir por un extremo y a congelarse por el otro de forma espontánea, aun cuando siga cumpliéndose la condición de conservación de la energía del sistema (el primer principio de la termodinámica).
Entropía y reversibilidad
La entropía global del sistema es la entropía del sistema considerado más la entropía de los alrededores. También se puede decir que la variación de entropía del universo, para un proceso dado, es igual a su variación en el sistema más la de los alrededores:
Si se trata de un proceso reversible, ΔS (universo) es cero, pues el calor que el sistema absorbe o desprende es igual al trabajo realizado. Pero esto es una situación ideal, ya que para que esto ocurra los procesos han de ser extraordinariamente lentos, y esta circunstancia no se da en la naturaleza. Por ejemplo, en la expansión isotérmica (proceso isotérmico) de un gas, considerando el proceso como reversible, todo el calor absorbido del medio se transforma en trabajo y Q= -W. Pero en la práctica real el trabajo es menor, ya que hay pérdidas por rozamientos, por lo tanto, los procesos son irreversibles.
Para llevar al sistema nuevamente a su estado original, hay que aplicarle un trabajo mayor que el producido por el gas, lo que da como resultado una transferencia de calor hacia el entorno, con un aumento de la entropía global.
Como los procesos reales son siempre irreversibles, siempre aumentará la entropía. Así como la energía no puede crearse ni destruirse, la entropía puede crearse pero no destruirse. Es posible afirmar entonces que, como el Universo es un sistema aislado, su entropía crece constantemente con el tiempo. Esto marca un sentido a la evolución del mundo físico, que se conoce como principio de evolución.
Cuando la entropía sea máxima en el Universo, esto es, cuando exista un equilibrio entre todas las temperaturas y presiones, llegará la muerte térmica del Universo (enunciada por Clausius).
En el caso de sistemas cuyas dimensiones sean comparables a las dimensiones de las moléculas, la diferencia entre calor y trabajo desaparece y, por tanto, parámetros termodinámicos como la entropía, la temperatura y otros no tienen significado. Esto conduce a la afirmación de que el segundo principio de la termodinámica no es aplicable a estos microsistemas, porque realmente no son sistemas termodinámicos. Se cree que existe también un límite superior de aplicación del segundo principio, de tal modo que no se puede afirmar su cumplimiento en sistemas infinitos como el Universo, lo que pone en controversia la afirmación de Clausius sobre la muerte térmica del Universo.
Historia de la entropía
El concepto de entropía desarrollado en respuesta a la observación de que una cierta cantidad de energía liberada de funcionales reacciones de combustión siempre se pierde debido a la disipación o la fricción y por lo tanto no se transforma en trabajo útil. Los primeros motores de calor como Thomas Savery (1698), el Newcomen motor (1712) y el Cugnot de vapor de tres ruedas (1769) eran ineficientes, la conversión de menos del 2% de la energía de entrada en producción de trabajo útil; una gran cantidad de energía útil se disipa o se pierde en lo que parecía un estado de aleatoriedad inconmensurable. Durante los próximos dos siglos los físicos investigaron este enigma de la energía perdida, el resultado fue el concepto de entropía.
En la década de 1850, Rudolf Clausius estableció el concepto de sistema termodinámico y postula la tesis de que en cualquier proceso irreversible una pequeña cantidad de energía térmica δQ se disipa gradualmente a través de la frontera del sistema. Clausius siguió desarrollando sus ideas de la energía perdida, y acuñó el término «entropía». Durante el próximo medio siglo se llevó a cabo un mayor desarrollo, y más recientemente el concepto de entropía ha encontrado aplicación en el campo análogo de pérdida de datos en los sistemas de transmisión de información.
Interpretación estadística de la entropía
En los años 1890 – 1900 el físico austríaco Ludwig Boltzmann y otros desarrollaron las ideas de lo que hoy se conoce como mecánica estadística, teoría profundamente influenciada por el concepto de entropía. Una de las teorías termodinámicas estadísticas (la teoría de Maxwell-Boltzmann) establece la siguiente relación entre la entropía y la probabilidad termodinámica:
-
,
donde S es la entropía, k la constante de Boltzmann y Ω el número de microestados posibles para el sistema (ln es la función logaritmo natural). La ecuación asume que todos los microestados tienen la misma probabilidad de aparecer.
La ecuación se encuentra grabada sobre la lápida de la tumba de Ludwig Boltzmann en el Zentralfriedhof (el cementerio central) de Viena. Boltzmann se suicidó en 1906, profundamente deprimido, quizá por la poca aceptación de sus teorías en el mundo académico de la época.
El significado de la ecuación es el siguiente:
|
Uno de los aspectos más importantes que describe esta ecuación es la posibilidad de dar una definición absoluta al concepto de la entropía. En la descripción clásica de la termodinámica, carece de sentido hablar del valor de la entropía de un sistema, pues sólo los cambios en la misma son relevantes. En cambio, la teoría estadística permite definir la entropía absoluta de un sistema.
La entropía es una magnitud física básica que dio lugar a diversas interpretaciones, al parecer a veces en conflicto. Han sido, sucesivamente, asimilados a diferentes conceptos, como el desorden y la información. La entropía mide tanto la falta de información como la información. Estas dos concepciones son complementarias. La entropía también mide la libertad, y esto permite una interpretación coherente de las fórmulas de entropía y de los hechos experimentales. No obstante, asociar la entropía y el desorden implica definir el orden como la ausencia de libertad.5 El desorden o la agitación guardan relación con la temperatura.
Entropía y desorden
Cuando la energía es una degradada, dijo Boltzmann, se debe a que los átomos asumen un estado más desordenado. Y la entropía es un parámetro del desorden: ésa es la concepción profunda que se desprende de la nueva interpretación de Boltzmann. Por extraño que parezca, se puede crear una medida para el desorden; es la probabilidad de un estado particular, definido aquí como el número de formas en que se puede armar a partir de sus átomos
Jacob Bronowski. El ascenso del hombre (The Ascent of Man). Bogotá, Fondo Educativo Interamericano, 1979, p. 347, capítulo 10 «Un mundo dentro del mundo».
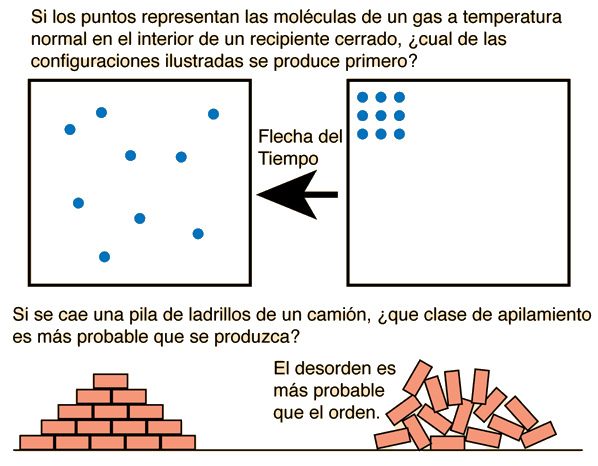
Coloquialmente, suele considerarse que la entropía es el desorden de un sistema, es decir, su grado de homogeneidad. Un ejemplo doméstico sería el de lanzar un vaso de cristal al suelo: tenderá a romperse y a esparcirse, mientras que jamás será posible que, lanzando trozos de cristal, se construya un vaso por sí solo. Otro ejemplo doméstico: imagínense dos envases de un litro de capacidad que contienen, respectivamente, pintura blanca y pintura negra; con una cucharita, se toma pintura blanca, se vierte en el recipiente de pintura negra y se mezcla; luego se toma pintura negra con la misma cucharita, se vierte en el recipiente de pintura blanca y se mezclan; el proceso se repite hasta que se obtienen dos litros de pintura gris, que no podrán reconvertirse en un litro de pintura blanca y otro de pintura negra; la entropía del conjunto ha ido en aumento hasta llegar a un máximo cuando los colores de ambos recipientes son sensiblemente iguales (sistema homogéneo).
No obstante, considerar que la entropía es el desorden de un sistema sin tener en cuenta la naturaleza del mismo es una falacia. Y es que hay sistemas en los que la entropía no es directamente proporcional al desorden, sino al orden.
Entropía como creadora de orden
A pesar de la identificación entre la entropía y el desorden, hay muchas transiciones de fase en la que emerge una fase ordenada y al mismo tiempo, la entropía aumenta. En este artículo se muestra que esta paradoja se resuelve haciendo una interpretación literal de la famosa ecuación de Boltzmann S = k log W. Podemos verlo en la segregación de una mezcla tipo coloide, por ejemplo cuando el agua y aceite tienden a separarse. También en la cristalización de esferas duras: cuando agitamos naranjas en un cesto, éstas se ordenan de forma espontánea. De estos casos se deduce el concepto de fuerza entrópica o interacción, muy útil en la ciencia de polímeros o ciencia coloidal.
El astrofísico Alan Lightman reconoció que a los científicos “les parece misterioso el hecho de que el universo fuera creado con este elevado grado de orden”. Agregó que “cualquier teoría cosmológica viable debería explicar en última instancia esta contradicción de la entropía”, es decir, que el universo no se halle en estado caótico.7
De acuerdo con Ilya Prigogine, galardonado con el Premio Nobel de Química en 1977, «la producción de entropía contiene siempre dos elementos dialécticos: un elemento creador de desorden, pero también un elemento creador de orden. Y los dos están siempre ligados». Prigogine ejemplifica esta afirmación con el caso de un sistema compuesto de dos cajas comunicantes que contienen una mezcla de nitrógeno e hidrógeno. Si la temperatura del sistema es homogénea, también lo será la distribución del hidrógeno y el nitrógeno, pero si se somete al sistema a una constricción térmica se genera una disipación, un aumento de la entropía, pero también del orden, ya que el hidrógeno predominará en una de las cajas y el nitrógeno en la otra (fenómeno de antidifusión).
Relación de la entropía con la teoría de la información
Recientes estudios han podido establecer una relación entre la entropía física y la entropía de la teoría de la información gracias a la revisión de la física de los agujeros negros. Según la nueva teoría de Jacob D. Bekenstein el bit de información sería equivalente a una superficie de valor 1/4 del área de Planck. De hecho, en presencia de agujeros negros la segunda ley de la termodinámica sólo puede cumplirse si se introduce la entropía generalizada o suma de la entropía convencional (Sconv) más un factor dependiente del área total (A) de agujeros negros existente en el universo, del siguiente modo:
Donde, k es la constante de Boltzmann, c es la velocidad de la luz, G es la constante de la gravitación y 
Los agujeros negros almacenarían la entropía de los objetos que engulle en la superficie del horizonte de sucesos. Stephen Hawking ha tenido que ceder ante las evidencias de la nueva teoría y ha propuesto un mecanismo nuevo para la conservación de la entropía en los agujeros negros.
Simplemente, al realizar un trabajo, se ocupa muy poca energía; la entropía se encarga de medir la energía que no es usada y queda reservada en un cuerpo.
Como flecha del tiempo
Como se demuestra en el Segundo Principio de la Termodinámica, de los dos únicos sentidos en que puede evolucionar un sistema el espontáneo es el que corresponde al estado del universo con una igual o mayor entropía. Se entiende por lo tanto que la entropía del universo tiene un único sentido: es creciente. Es equiparable al paso del tiempo, cuyo sentido a ojos de la vida humana es siempre el mismo. El tiempo pasa y la entropía crece hasta alcanzar el punto de máxima entropía del universo, el equilibrio termodinámico. A modo tanto de cuestión filosófica como de cuestión científica este concepto recae inevitablemente en la paradoja del origen del universo. Si el tiempo llevara pasando infinitamente la entropía del universo no tendría sentido, siendo esta un concepto finito creciente en el tiempo y el tiempo un concepto infinito y eterno.


















