DIVISIBILIDAD DE LA MATERIA
DIVISIBILIDAD DE LA MATERIA. Podemos definir a la divisibilidad en química como una propiedad de la materia que le permite separarse en porciones más pequeñas.
Para entender el concepto podemos poner un ejemplo. Si tomamos una hogaza de pan y la cortamos por la mitad una y otra vez, ¿llegaremos alguna vez a un bloque fundamental de la materia que no se pueda dividir más? Esta cuestión ha estado presente en la mente de científicos y filósofos durante miles de años.

Origen y concepto de la divisibilidad química
Durante muchísimo tiempo se debatió si la materia estaba conformada por partículas (la que hoy conocemos como átomos), sin embargo, la idea general era que la materia era un continuo que podía dividirse.
Este concepto generalizado hizo víctima de burla a científicos brillantes como James Clerk Maxwell (de las ecuaciones de Maxwell) y Ludwing Boltzman (de la distribución de Boltzman) cosa que arrastró al primero a la locura y al segundo al suicidio.
En el siglo V a.C., el filósofo griego Leucipo y su discípulo Demócrito utilizaron la palabra átomos para designar la más pequeña pieza individual de la materia y propusieron que el mundo no consiste en más que átomos en movimiento.
Esta teoría atómica temprana difería de versiones posteriores puesto que incluía la idea de un alma humana compuesta de un tipo más refinado del átomo distribuido a través del cuerpo.
La teoría atómica cayó en declive en la Edad Media, pero revivió al comienzo de la revolución científica en el siglo XVII.
Grados de división de los cuerpos.
La experiencia enseña que por la acción de agentes mecánicos y físicos los cuerpos pueden dividirse en partículas cada vez más pequeñas, conservando las mismas propiedades del cuerpo de que proceden. La divisibilidad no es infinita y de esto ya tenían idea los filósofos de la antigüedad griega al admitir que todos los cuerpos estaban formados por partículas insignificantes yuxtapuestas, que venían a ser como pequeñas unidades constitutivas.
A las porciones límites a las cuales se puede llagar por división sin que por ello las partículas dejen de tener las propiedades del todo, se les llama moléculas (diminutivo latino de moles, masa).

Noción de moléculas.
Moléculas son las porciones más pequeñas de la materia en que puede dividirse una substancia sin perder sus propiedades químicas características.
Por lo tanto, todo cuerpo se puede considerar como un agregado de moléculas cuyas propiedades son la de los cuerpos a que pertenece considerar en ese sentido, a cada una de ellas, como una imagen reducida de aquel.
Las moléculas no se tocan entre sí (lo que en lenguaje científico equivale decir que la materia no es continua) sino que están separadas por espacios vacios, llamados espacios intermoleculares; la observación de estos, a pesar de ser su tamaño mucho mayor que el que presentan las moléculas, escapa a nuestros sentidos y a los instrumentos ópticos de la ciencia actual.

Hipotéticamente se admite que los espacios intermoleculares no tienen las mismas dimensiones en todas las substancias y que en cada una de ellas varían de tamaño y ubicación según la presión, la temperatura y el estado físico, los fenómenos de dilatación y compresión son debido a las variaciones de volumen de estos espacios. Estos fenómenos, conjuntamente con otros hechos cuyo análisis escapa al marco de una explicación elemental, hace que la ciencia de hoy en día vea en la materia de que están integrados los cuerpos, y no un sistema continuo, sino un sistema discreto o discontinuo, compuesto de pequeñísimos gránulos o corpúsculos que se mantienen en aislada y nutrida aglomeración en virtud de fuerzas no bien del todo estudiadas hasta la fecha, y que se distinguen con el nombre de cohesión.
La cohesión molecular.
Por cohesión (del latín cohaesum, estar unidos) se entiende en Física, y también en Química, la unión o trabazón íntima que existe entre las moléculas de un cuerpo y que impide que se disgreguen. En los sólidos la cohesión es máxima, en los líquidos es menor y en los gases no existe. Por eso se observa que en los gases las moléculas en vez de unirse se repelen.

La fuerza de cohesión solo se manifiesta a distancias sumamente pequeñas. La prueba está en que si se rompe un cuerpo (vidrio por ejemplo) sus moléculas no vuelven a unirse aunque yuxtapongamos con fuerza, los fragmentos. Dos trozos de plomo pueden unirse con firmeza, pero a costa de una presión enorme que aproxime sus moléculas y las haga entrar en sus respectivas zonas de atracción mutua.
Las moléculas, por su extrema pequeñez, no se alcanzan a ver aisladamente, pero se manifiestan en bloque: son los cuerpos que nos rodean. Cuando tocamos un vaso no estamos tocando más que las superficies externas de unas moléculas cuyas propiedades particulares hacen que las llamemos vidrio.
Vidrio es cada molécula, y de vidrio, o sea de molécula de vidrio, es todo el vaso. No podría existir el material vidrio, visible y tangible si no, existieran esas pequeñísimas unidades o células de vidrio que la constituye, llamadas moléculas, y cuya acumulación en números inmensos hace que el material vidrio tenga precisamente la existencia real que aprecian nuestros sentidos. Si, el vidrio se disgregara en sus numerosos moléculas, nosotros ignoraríamos probablemente la existencia de material vidrio, pues ni nuestra vista ni el instrumento actual más poderoso serían capases de percibir el tamaño de una molécula ni mucho menos distinguir sus propiedades. Lo que nos permite conocer la existencia de las moléculas es precisamente esa causa natural que las mantiene unidas en número muy grande, formando cuerpos, causa que se presenta en forma de una fuerza coercitiva que, para distinguirla de otras manifestaciones de la fuerza o energía la titulamos fuerza de cohesión o simplemente cohesión. Al efecto que produce esa fuerza unitiva, o sea al hecho de encontrarse y permanecer las moléculas fuertemente trabadas entre sí, también lo llamamos cohesión.
Las moléculas no se tocan entre sí, sino que están separadas unas de otras por los llamados espacios intermoleculares.
La observación de estos espacios, al igual que el de las moléculas, es inaccesible a nuestros sentidos, a pesar de ser los espacios intermoleculares de dimensiones mayores que las mismas moléculas, según ha podido deducir la ciencia.
Los fenómenos de dilatación y contracción, así como los cambios de estado de la substancia, se interpretan en la hora actual como causada por variaciones de volumen de estos espacios intermoleculares. Además las moléculas poseen, como veremos luego, un movimiento cuyo radio de acción varía según que el estado de la substancia sea sólido, líquido o gaseoso.
En los sólidos, el radio de acción de cada molécula es muy pequeño, pues la fuerza de cohesión (que como luego veremos es una manifestación de la energía) mantiene constante las distancias relativas que existen entre ellas, y es por esto que los sólidos mantienen una forma propia por el contrario, en el estado gaseoso, las moléculas se separan unas de otras, y el gas ocupa todo el volumen de que dispone, y hasta fuerza las paredes de la vasija que los contiene tratando de evadirse y determinando lo que llamamos presión.
En los líquidos la cohesión se manifiesta en menor grado que en los sólidos, y no poseen la rigidez necesaria para mantener su forma propia.
En general, la temperatura y la presión modifican el valor de la cohesión. Si se eleva la temperatura, aumenta el efecto de repulsión molecular, y si la disminuye, aumenta el efecto contrario, o sea lo que actúa el efecto de cohesión. En cambio, el aumento de presión favorece la cohesión y su disminución incrementa la repulsión.
Los grados de cohesión no solo varían en los distintos estados de una misma substancia, sino que también ofrecen diferencias de una substancia a otra. Así, en el hierro, plomo, hielo, manteca, etc., la cohesión tiene un alto grado unitivo, pero varia en intensidad de una substancia a otra, como es notario, el mayor grado de cohesión se da en aquel cuerpo que ofrece la mayor resistencia a la disgregación. Entre los precitados seria el hierro.
Noción de átomo.
Según la definición clásica, diremos que la moléculas sólo representa el último grado de división de la materia a que pueda llegarse por medios mecánicos, y que químicamente existe la posibilidad de una división menor, merced a la cual se desintegra la molécula en sus partes constitutivas, que reciben el nombre de átomos (del griego lo indivisible).
Así, como las moléculas que integran los cuerpos son independientes unas de otras, pero se mantienen unidas por obra de la fuerza que llamamos de cohesión, así también los átomos que constituyen la molécula se mantienen reunidos dentro de ella por obra de una fuerza que en este caso llamamos de afinidad química. Esta fuerza es la que actuando con carácter selectivo entre átomos de distinta naturaleza posibilita que se desplacen de sus respectivas moléculas para forma otras nuevas, dando origen a las reacciones químicas.

Los átomos que entran en una molécula lo hacen siempre un número entero y fijo para cada tipo de substancia. Cuando la molécula consta de un solo átomo (caso del cinc, por ejemplo), cabe llamársele con igual propiedad molécula o átomo, indistintamente, ya que se trata aquí de dos entes o elementos que se mantienen una al otro sino de un solo y mismo ente. El uso, sin embargo, y cierto orden de clasificación, hacen que a la molécula formada por un solo átomo se le llama molécula monoatómica (mono del griego uno). A la que esta constituida por dos átomos se la titula biatómica a la de tres átomos; a la de cuatro tetra atómica, etc.
Si bien los átomos son aquellas porciones más pequeñas de materia que tan solo se ponen en libertad por vía química, mudándose de una molécula a otra para originar nuevas substancias, estrictamente hablando existe un grado de división menor que este cuyo estudio es una adquisición de la ciencia de los últimos tiempos y que en la actualidad preocupa a los grandes físicos y químicos. En efecto, por procedimientos especiales ha podido descomponerse el átomo en gránulos o corpúsculos eléctricos positivos, llamados protones y granuloso corpúsculos eléctricos positivos, llamados protones, y gránulos o corpúsculos eléctricos negativos, llamados electrones.
A su tiempo volveremos sobre la hipotética constitución del átomo. Por ahora anticipamos que la cantidad de electricidad positiva total que poseen los protones, esta equilibrado por la negativa que tienen los electrones, con lo cual el átomo resulta neutro: pero puede éste estar electrizado si gana o pierde electrones. En el primer caso exhibirá carga negativa: en el segundo, positiva. En estas condiciones, el átomo recibe el nombre de ion, si el ion es positivo, se llama catión; si es negativo anión. El termino ion se deriva del griego, y significa el que va, el que es caminante; por lo tanto, el catión es el que camina hacia el cátodo, y el anión el que dirige hacia el ánodo.
Atomicidad.
Es el número de átomos que contiene la molécula de un cuerpo simple, como hemos dicho en el párrafo anterior. Por su atomicidad, los elementos se clasifican en monoatómicos, biatómicos, triatómicos, etc. Tenemos como ejemplo de los primeros a los metales en estado de vapor; de los segundos, al nitrógeno, oxígeno, nitrógeno, cloro, etc. (Véase Tabla II, donde se marcan las atomicidades de los elementos químicos).

Se halla la atomicidad de un cuerpo simple dividiendo el peso de su molécula por el caso de uno de los átomos que la componen, o lo que da lo mismo, dividiendo su peso molecular por su peso atómico. Así el peso molecular del oxígeno, O, es 32: peso atómico 16. Luego en atomicidad, o sea el número de átomos que contiene cada uno de sus moléculas, es de 32: 16=2. La molécula de oxígeno es pues, biatómica (o diatónica como también suele llamársela).
Peso atómico.
Se llama peso atómico de un cuerpo simple dividiendo el peso de su molécula por el peso de uno de los átomos que la componen, o lo que da lo mismo, dividiendo su peso molecular por su peso atómico. Así el peso molecular del cloro, Cl, es de 35,46; lo cual significa que cada átomo de cloro pesa 35,46 veces más que cada átomo de hidrógeno.
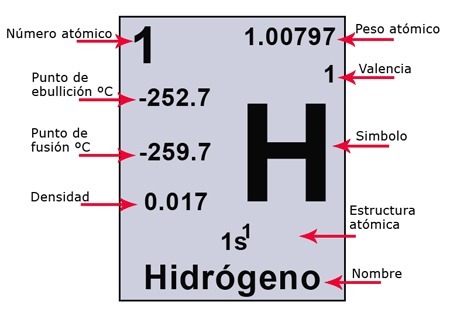
Según la definición dada de peso atómico, al hidrógeno le correspondería el valor 1, por tomárselo como unidad de comparación. Sin embargo, si no fijamos en la Tabla I, observaremos que el hidrógeno le corresponde el valor de 1,0081.
Esta diferencia, prácticamente despreciable respecto de la unidad, obedece a que, modernamente, se prefiere tomar como unidad de comparación la dieciséis aba parte (¹/16) del peso de un átomo de oxígeno.
Peso molecular.
Puesto que el átomo tiene peso, con mayor razón lo tendrá la molécula, que contiene siempre a uno o más átomos. El peso de la molécula, tomada con relación al átomo de hidrógeno (o ¹/16 del oxígeno), se le llama peso molecular relativo, o simplemente peso molecular. Como todas las reacciones químicas giran en torno al valor de la molécula, el peso molecular asume gran importancia, y sobre el nos detendremos en su oportunidad. Por ahora bastará con recordar las definiciones de atomicidad, peso atómico y peso molecular, a fin de diferenciar una relación de otra.

Substancias simples y compuestas.
Los átomos que forman la molécula pueden ser idénticos o diferentes, vale decir, de la misma o de distinta naturaleza. En el primer caso se dice que la molécula sea simple y pertenece por lo tanto a una substancia simple.
El número de átomos que contiene una molécula simple puede variar y depende, no solo de la substancia en si misma, sino de la temperatura, presión. Etc., a que se halla sometida.
Si los átomos que forman una molécula son de distinta naturaleza, la molécula pertenece a una substancia compuesta.
El número de substancias compuestas es tan grande que se calcula en ciento de miles (*). La cantidad de átomos que contiene la molécula compuesta varía desde dos hasta un número más o menos grande. Por ejemplo, la quinina contiene 48 átomos.
Esta clasificación de las substancias en simples y compuestas es la que más interesa al químico, pero se clasifican desde otros puntos de vista.
Así por su origen pueden ser naturales o artificiales según se encuentran espontáneamente en la naturaleza o se hayan obtenido en el laboratorio.
Son ejemplos de las primera el azufre, el oro, el agua, el mármol, la piedra de imán, etc. También a esta categoría pertenecen las substancias de origen animal y vegetal, como las grasas, los aceites, la nicotina, etc. Todas las substancias obtenidas por el hombre en el laboratorio experimental o en la industria, imitando a las substancias artificiales. Tenemos en esta categoría la seda artificial, los colores de anilina, el éter, la aspirina, la bakelita, etc.

También se las pueda dividir en minerales y orgánicas; lo primero, si proceden del reino mineral; lo segundo, si salen de los reinos animal o vegetal.
La división de las substancias en minerales y orgánicas resulta, como la anterior, un poco artificiosa en el estado actual de la ciencia química, pues, es evidente que muchas substancias artificiales son idénticas a las naturales que es casi imposible reconocer su origen. Por otra parte el agua, la sal de cocina, etc., consideradas como substancias minerales naturales, no solo se encuentran en la corteza terrestre y en la atmosfera, si no que forma parte de los tejidos de los seres vivientes (animales y vegetales). Se obtienen también por síntesis de laboratorio. Luego veremos divisiones más especificas de las substancias.
Nociones de elementos químicos.
Hemos dicho que las moléculas de las substancias simples se caracterizan por estar formadas por átomos de la misma clases, ejemplo: claro gaseoso, hidrógeno gaseoso, sodio metálico. Las substancias compuestas por el contrario, están constituidas por moléculas formadas por átomos diferentes, ejemplo: cloruro de sodio, agua. Estudiando la composición de las moléculas de las substancias citadas, se observa que ellas están constituidas por átomos de hidrógeno, cloro, sodio y oxígeno, los cuales se combinan de diferentes maneras para dar origen a unas moléculas u otras. Así de la unión de dos átomos iguales de hidrógeno obtenemos una molécula de la substancia simple hidrógeno y de la unión de dos átomos de hidrógeno con una de oxígeno resulta una molécula de la substancia compuesta agua.

Se llama elemento a cada clase diferente de átomos. En nuestros ejemplos aparecen los elementos hidrógeno, cloro, oxígeno y sodio. En la actualidad se conocen noventa clases de átomos distintos o elementos. Ellos aparecen en la Tabla I donde figuran con su nombre y símbolo respectivo, peso atómico, número de orden, estado de agregación que corresponde al estado libre o substancia simple: y valencias usuales.
En realidad un elemento puede formar más de una substancia simple, por ejemplo el elemento oxígeno puede dar origen a la substancia simple oxígeno. (O2), o bien a la substancia simple (O3). Pero muchas veces se usa el nombre de elemento para designar a la substancia simple que lo contiene y por eso es común hablar del elemento oxígeno, hidrógeno, etc., al referirse a las substancias simples oxígeno e hidrógeno formados por dos átomos de oxígeno e hidrógeno respectivamente.
Afinidad química.
Cuando dos substancias simples, verbigracia menté, el oxígeno y el hierro, reaccionan químicamente el compuesto óxido de hierro, los átomos de uno y otro elemento se separan de sus respectivas moléculas creando una tercera molécula resultante, de naturaleza distinta, que no es de oxígeno ni de hierro sino de óxido de hierro. Fe2O3.

A la fuerza que tiende a unir estos átomos para formar una nueva molécula, se la llama afinidad química
Esta fuerza es una manifestación de la energía química que poseen los cuerpos y tienen la particularidad de ser selectiva. Habrá entonces substancias que reaccionaran vivamente entre sí, otras que lo harán con menor energía, y finalmente algunas cuya reacción será cero o nula. Por lo que hemos adjudicado a la afinidad el poder de mantener integrada en sí mismo a la molécula, esto es, con todos sus átomos reunidos, surge aquí una aparente contradicción que conviene aclarar. Existen, diríamos, para explicarnos brevemente, dos sentidos de fuerzas en la afinidad. Uno seria de afinidad atómica interna o cohesión entre átomos (no confundir con cohesión entre moléculas que mantiene unitaria a la molécula. El otro sentido o tendencia es la afinidad externa, o sea a la fuerza que llama a unirse a átomos de determinado tipo cuando se encuentran uno frente a otro, o mejor dicho, uno en contacto con otro, en distintas moléculas. Esta especie de “simpatía” o atracción con que se mantienen solidarios los átomos de la misma molécula. Cuando la simpatía externa es mayor que la interna se vence la atracción intima que agrupa a los átomos y la molécula se abre, entregando el átomo o átomos solicitados.
En resumen, por afinidad química debe entenderse la atracción que tienen los átomos de una molécula para con los de otra cualquiera, atracción que resulta en una combinación química o sea la formación de un nuevo cuerpo, cuando las combinaciones son las adecuadas.
Energía y afinidad química.
Para igualar condiciones de experimentación, cuanto más viva es una reacción química, tanto mayor se dice que es la afinidad que tiende a formar el compuesto resultante.
Como índice del grado de vivacidad o energía con que se desarrollan las reacciones puede tomarse la cantidad la cantidad de trabajo (mecánico) que desarrollan las fuerzas químicas en el transcurso de cambio químico. Este trabajo puede medirse por la cantidad de calor que se absorbe o desprende en la reacción, y se expresa en calorías.

Estos conceptos se ver{an con más amplitud en el capitulo d Termoquímica.
Causas que favorecen las reacciones.
La afinidad química no es una forma de la energía que se manifiesta a distancia, tal como lo hacen, por ejemplo, el calor, la inducción, eléctrica o el electromagnetismo, sino a proximidad tan estrecha que las moléculas reaccionantes deben estar prácticamente en contacto, a igualdad de otros factores, tanto más viva la reacción. Por eso, substancias que en estado sólido reaccionan con velocidad casi nula, aceleran su intercambio interatómico cuando se hallan líquidas, y demuestran una facilidad de combinación sorprendente si se las mezcla en fase gaseosa. El estado gaseoso es el que a igualdad de masa reaccionantes ofrece el máximo de puntos superficiales de contacto.
Por reacciones técnicas las reacciones artificiales o de laboratorio suelen efectuarse con los cuerpos al estado líquido o en solución. Esto es lo que antiguos químicos expresaban con el conocido adagio: “corpora non agunt nisi soluta”, lo que equivale a decir, que los cuerpos se combinan mejor al estar disgregados.

El calor modifica la velocidad de reacción, favoreciéndola generalmente a temperaturas moderadas. A muy altas como a muy baja temperaturas, la reacción progresa tan lentamente que apenas alcanza a manifestarse. En general, a -200°C queda anulada para todos los cuerpos la posibilidad de reaccionar.
La influencia de la luz se pone en evidencia en muchísimos casos. La mezcla de los gases cloro e hidrógeno, secos, puede conservarse al abrigo de la luz sin que estos se modifiquen, pero si se exponen a los rayos solares se combinan inmediatamente con explosión, produciendo acido clorhídrico.
Otras veces la influencia de la luz es negativa, es decir provoca descomposiciones, como sucede con las placas fotográficas, en las cuales, al ser expuestas, las sales de plata que forman la emulsión sensible se descomponen. La electricidad también influye: según como sea empleada esta energía, favorece o impide las reacciones químicas. Así en forma de chispa eléctrica provoca la combinación de una mezcla de oxígeno e hidrógeno para formar agua. En la forma de corriente eléctrica, es el agente principal de la descomposición llamada electrólisis.
Reacciones exotérmicas y endotérmicas.
En todas las reacciones químicas, la energía calorífica se pone en juego modificándola temperatura de los cuerpos reaccionantes.
Para obtener la cal viva (oxido de calcio) de las piedras calcáreas, se someten estas a la acción del calor, parte del cual queda luego almacenado en la cal viva al estado de energía potencial.

Cuando, como el ejemplo anterior, los cuerpos absorben calor externo al reaccionar químicamente, se dice que la reacción es endotérmica. Como ejemplo contrario, veamos que si se vierte agua sobre la cal viva para apagarla (formándose hidróxido de calcio), se produce una elevación de temperatura tal, que hace entrar en ebullición el agua. Al acto químico en el que se desprende calor, se lo llama reacción exotérmica.
Las combinaciones en general son reacciones exotérmicas, producidas por la combinación del combustible con el oxígeno del aire.
Definición de la química.
La Química es la ciencia que tiene por objeto el estudio de las propiedades de los cuerpos simples y compuestos, las combinaciones de unos con otros que originan en ellos cambios substanciales, y las leyes que regulan estas combinaciones. Por consiguiente, la Química, que es una rama de las ciencias naturales. Trata de las relaciones y combinaciones de los átomos, y estudia las propiedades de la materia y los cambios que alteran su composición. Es decir, que al ser los átomos parte integrante de la molécula, viene a estudiar en general las causas que modifican la estructura y constitución de estas últimas.










